![]()
強(つよ)い酸を含(ふく)む雨が降ったおかげで、ビルや道路のアスファルトが溶(と)けたり、鉄(てつ)や銅(どう)でつくられた金属(きんぞく)の像(ぞう)が溶(と)けたり、野菜(やさい)・花・木などの植物(しょくぶつ)が、かれてしまうなど大きな影響(えいきょう)を及(およ)ぼしている話をきいたことありませんか? このような影響を与(あた)える強い酸性の雨を酸性雨(さんせいう)と呼びます。
北欧(ほくおう)のノルウェーやスウェーデン、北アメリカのカナダでは1960年代後半くらいから酸性雨による被(ひ)がいが顕著(けんちょ)にあらわれてきました。湖(みずうみ)や沼(ぬま)が酸性化(さんせいか)して、そこを住処(すみか)にしていた魚がしんでしまったり、森や林の木がかれてしまいました。
また、ドイツで有名(ゆうめい)なシュバルツバルトの森ですが、大部分(だいぶぶん)を酸性雨でやられてしまいました。ほかにドイツ、チェコやポーランドの国境(こっきょう)あたりに広がる森林も酸性雨により樹木(じゅもく)がかれてしまい、葉が黄色くなってしまう現象(げんしょう)もみられました。
日本においても昭和50年ごろから酸性雨の被がいがみられるようになりました。関東(かんとう)や近畿地方(きんきちほう)では、雨が降った後に葉が変色(へんしょく)していたり、白く脱色(だっしょく)しているというものまででるようになりました。
酸性雨になる原因(げんいん)は、工場や車の排(はい)ガスに含まれている硫黄酸化物(いおうさんかぶつ)と窒素酸化物(ちっそさんかぶつ)などといった物質(ぶっしつ)です。これら大気汚染の原因となる物質が、大気内で化学反応(かがくはんのう)を繰(く)り返(かえ)すことで、より強力な硫酸(りゅうさん)や硝酸(しょうさん)などの強い酸になってしまいます。強い酸が雨、霧(きり)や雪(ゆき)などの中にまぎれこみ、そのまま地上(ちじょう)にふりそそぎます。
また、雨の中に溶け込(こ)まず、硫酸や硝酸などの物質がそのままで大気内をさまよう霧みたいな酸性雨も報告(ほうこく)されています。雨の中に含まれているものより濃度(のうど)が強く、比例(ひれい)して被がいも大きくなってしまいます。 酸性雨の被がいは生物(せいぶつ)のみでないことは、上記(じょうき)でも述べました。大理石(だいりせき)、コンクリートなどをはじめ、金属製(きんぞくせい)のものまで溶かしてしまいます。歴史的(れきしてき)な建造物(けんぞうぶつ)や彫刻(ちょうこく)などの多(おお)いことで知られるヨーロッパでは酸性雨により、それらが溶けてしまうという被がいがでています。
日本では、青銅(せいどう)でつくられた像(ぞう)が酸性雨によって表面(ひょうめん)が溶けてしまい、白い線(せん)が残ってしまう被がいも出ています。草木などの植物が酸性雨によりかれてしまったという報告が上がっていますが、沼や湖の魚がしんでしまったという報告はいまのところでていません。これは、日本の川、湖や沼の底の土壌層(どじょうそう)が厚(あつ)いという特徴(とくちょう)から、そこに含まれているアルカリ性成分(せいぶん)が水の中に溶け込むことにより、酸が中和(ちゅうわ)しているためです。このように現在においては、大きく目立った被がいがでておりませんが、これからも酸性雨が降り続けるのであれば、近い未来、酸性雨による被がいが誰の目から見てもわかりやすくなってしまうかもしれません。
酸性(さんせい)とアルカリ性の関係について
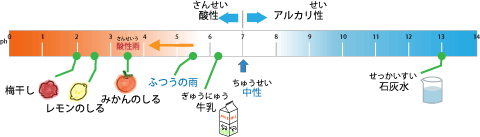
酸性、アルカリ性のどちらが強いかをはかるにはpH(ぴーえいち)という単位(たんい)を用いて0~14という数値内(すうちない)であらわします。pH7であると中間(ちゅうかん)の位置(いち)になりますので中和状態(ちゅうわじょうたい)となります。たとえば酸の強いレモンの汁のpHは2.5です。牛乳(ぎゅうにゅう)を調(しら)べてみるpH6.2でありちょっと酸性となります。一般的(いっぱんてき)には雨水のpHはやや酸性よりのpH5.6前後(ぜんご)になりますので、pH5.6以下の数値を示(しめ)す雨は酸性雨であるといえます。 平成10年から平成12年に降った雨の平均pHは4.72~4.90であり、強い酸性であったといえるでしょう。